Биология - Апоптоз - Фазы апоптоза
09 февраля 2011Оглавление:
1. Апоптоз
2. История исследования
3. Происхождение и эволюция апоптоза
4. Фазы апоптоза
5. Регуляция апоптоза
6. Роль апоптоза в многоклеточном организме
7. Патология, обусловленная нарушениями апоптоза
8. Другие формы гибели клетки
Процесс апоптоза можно условно разделить на три фазы: сигнальную, эффекторную и деградационную.
Сигнальная фаза
Инициация апоптоза может происходить посредством внешних или внутриклеточных факторов. Например, в результате гипоксии, гипероксии, субнекротического поражения химическими или физическими агентами, перекрёстного связывания соответствующих рецепторов, нарушения сигналов клеточного цикла, удаления факторов роста и метаболизма и т. д. Несмотря на разнообразие инициирующих факторов, выделяются два основных пути трансдукции сигнала апоптоза: рецептор-зависимый сигнальный путь с участием рецепторов гибели клетки и митохондриальный путь.
Рецептор-зависимый сигнальный путь
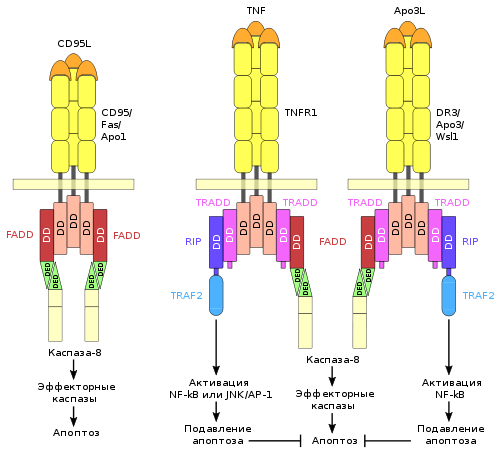
Процесс апоптоза часто начинается с взаимодействия специфических внеклеточных лигандов с рецепторами клеточной гибели, экспрессированными на поверхности клеточной мембраны. Рецепторы, воспринимающие сигнал апоптоза, относятся к суперсемейству TNF-рецепторов. Наиболее изученными рецепторами смерти, для которых описана и определена роль в апоптозе, являются CD95 и TNFR1. К дополнительным относятся CARI, DR3, DR4 и DR5.
Все рецепторы смерти представляют собой трансмембранные белки, характеризующиеся наличием общей последовательности из 80 аминокислот в цитоплазматическом домене. Данная последовательность называется доменом смерти и является необходимой для трансдукции сигнала апоптоза. Внеклеточные участки рецепторов смерти взаимодействуют с тримерами лигандов. Тримеры лигандов в результате взаимодействия тримеризуют рецепторы смерти. Активированный таким образом рецептор взаимодействует с соответствующим внутриклеточным адаптером. Для рецептора CD95 адаптером является FADD. Для рецепторов TNFR1 и DR3 адаптером является TRADD.
Адаптер, ассоциированный с рецептором смерти, вступает во взаимодействие с эффекторами — пока ещё неактивными предшественниками протеаз из семейства инициирующих каспаз — с прокаспазами. В результате цепочки взаимодействия «лиганд-рецептор-адаптер-эффектор» формируются агрегаты, в которых происходит активация каспаз. Данные агрегаты именуются апоптосомами, апоптозными шаперонами или сигнальными комплексами индуцирующими смерть. Примером апоптосомы может служить комплекс FasL-Fas-FADD-прокаспаза-8, в котором активируется каспаза-8.
Рецепторы смерти, адаптеры и эффекторы взаимодействуют между собой сходными по структуре доменами: DD, DED, CARD. DD участвует во взаимодействии рецептора Fas с адаптером FADD и во взаимодействии рецепторов TNFR1 или DR3 с адаптером TRADD. Посредством домена DED осуществляется взаимодействие адаптера FADD с прокаспазами −8 и −10. Домен CARD участвует во взаимодействии адаптера RAIDD с прокаспазой-2.
Посредством рецепторов смерти могут быть активированы три инициирующие каспазы: −2; −8 и −10. Активированные инициирующие каспазы далее участвуют в активации эффекторных каспаз.
Митохондриальный сигнальный путь
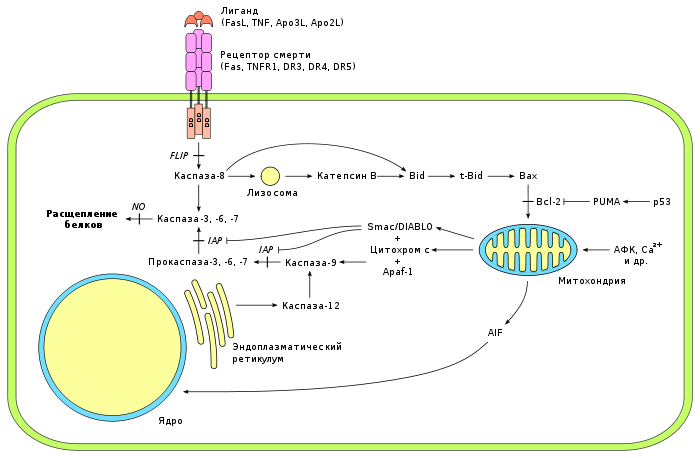
Митохондриальный сигнальный путь апоптоза реализуется в результате выхода апоптогенных белков из межмембранного пространства митохондрий в цитоплазму клетки. Высвобождение апоптогенных белков, предположительно, может осуществляться двумя путями: за счёт разрыва митохондриальной мембраны или же путём открытия высокопроницаемых каналов на внешней мембране митохондрий.

Разрыв внешней мембраны митохондрий объясняется увеличением объема митохондриального матрикса. Данный процесс связывают с раскрытием пор митохондриальной мембраны, приводящим к снижению мембранного потенциала и высокоамплитудному набуханию митохондрий вследствие осмотического дисбаланса. Поры диаметром 2,6—2,9 нм способны пропускать низкомолекулярные вещества массой до 1,5 кДа. Раскрытие пор стимулируют следующие факторы: неорганический фосфат; каспазы; SH-реагенты; истощение клеток восстановленным глутатионом; образование активных форм кислорода; разобщение окислительного фосфорилирования протонофорными соединениями; увеличение содержания Ca в цитоплазме; воздействие церамида; истощение митохондриального пула АТФ и др.
В качестве альтернативного пути выхода апоптогенных белков из межмембранного пространства митохондрий рассматривается вариант образования белкового канала во внешней митохондриальной мембране. Так или иначе, в цитоплазму высвобождаются: цитохром c — белок с молекулярной массой 15 кДа; прокаспазы −2, −3 и −9; AIF — флавопротеин с молекулярной массой 57 кДа.
Цитохром c в цитоплазме клетки участвует в формировании апоптосомы вместе с белком Apaf-1. Предварительно, Apaf-1 претерпевает конформационные изменения в результате реакции, протекающей с затратой энергии АТФ. Предполагается, что трансформированный Apaf-1 приобретает способность связывать цитохром c. К тому же открывается доступ CARD-домена Apaf-1 для прокаспазы-9. В итоге происходит олигомеризация не менее 8 субъединиц трансформированного белка Apaf-1 с участием цитохрома c и прокаспазы-9. Так образуется апоптосома, активирующая каспазу-9. Зрелая каспаза-9 связывает и активирует прокаспазу-3 с образованием эффекторной каспазы-3. Высвобождающийся из межмембранного пространства митохондрий флавопротеин AIF является эффектором апоптоза, действующим независимо от каспаз.
Другие пути индукции апоптоза
Стоит отметить, что реализация апоптоза может происходить в результате комбинированного действия двух основных сигнальных путей — рецептор-зависимого и митохондриального. Помимо этого, существует ряд менее распространённых механизмов инициации апоптоза. Например, за счёт активации прокаспазы-12, локализованной в эндоплазматическом ретикулуме. Высвобождение и активация прокаспазы-12 при этом обусловлены нарушениями внутриклеточного гомеостаза ионов кальция. Активация апоптоза также может быть связана с нарушением адгезии клеток.
В качестве ещё одного фактора индукции апоптоза рассматривается атака инфицированных клеток цитотоксическими Т-лимфоцитами, которые, помимо активации Fas-рецептора, способны секретировать перфорин вблизи мембраны заражённой клетки. Перфорин, полимеризуясь, образует трансмембранные каналы, через которые внутрь клетки поступают лимфотоксин-альфа и смесь сериновых протеаз. Далее гранзим B активирует каспазу-3 и запускается каспазный каскад.
Возможна инициация клеточной смерти при высвобождении лизосомальных протеаз — катепсинов. К примеру, каспаза-8 вызывает выход из лизосом активного катепсина B, который затем расщепляет регуляторный белок Bid. В результате образуется активный белок t-Bid, активирующий в свою очередь проапоптозный белок Bax.
Эффекторная фаза
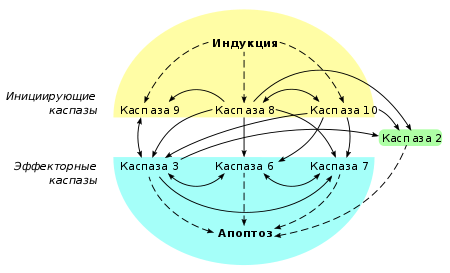
В течение эффекторной фазы различные инициирующие пути конвертируются в один общий путь апоптоза. Как правило, происходит активация каскада белков-эффекторов и регулирующих их белков-модуляторов. Основными эффекторами апоптоза являются каспазы. В процессе активации они запускают каспазный каскад: сложно переплетённые цепочки взаимодействий инициирующих и эффекторных каспаз.
Каспазный каскад
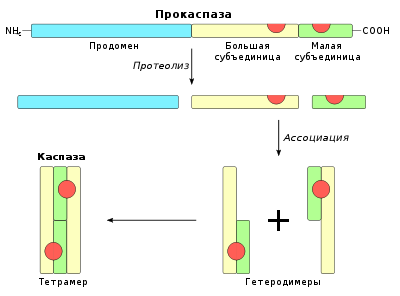
Каспазы представляют собой цистеиновые протеазы, которые расщепляют аминокислотные последовательности после остатка аспарагиновой кислоты. Каспазы образуются за счёт активации прокаспаз, в составе которых выделяют 3 домена: регуляторный N-концевой домен, большую и малую субъединицы. Активация происходит путём протеолитического процессинга: все три домена расщепляются, отделяется продомен, а оставшиеся большая и малая субъединицы ассоциируются, образуя гетеродимер. Два гетеродимера в дальнейшем формируют тетрамер — полноценную каспазу с двумя каталитическими участками.
Каспазы обнаружены во большинстве живых организмов. У млекопитающих идентифицировано 13 каспаз. Часть из них в апоптозе не участвует. Остальные каспазы, которые участвуют в апоптозе, разделяют на инициаторные и эффекторные. Инициаторные каспазы активируют эффекторные каспазы, которые в свою очередь провоцируют и непосредственно участвуют в трансформации клетки. В итоге морфологические и биохимические изменения приводят к гибели клетки по типу апоптоза.
Одна из основных функций эффекторных каспаз заключается в прямом и опосредованном разрушении клеточных структур. Гидролизу подвергаются белки ядерной ламины, разрушается цитоскелет, расщепляются белки, регулирующие клеточную адгезию. Другой важной функцией эффекторных каспаз является инактивация белков, блокирующих апоптоз. В частности расщепляется ингибитор DFF, препятствующий активации апоптозной ДНКазы CAD. Разрушению подвергаются и антиапоптозные белки семейства Bcl-2. Наконец, в результате действия эффекторных каспаз происходит диссоциация регуляторных и эффекторных доменов, участвующих в репарации ДНК, мРНК-сплайсинга и ДНК-репликации.
|
один из которых инициирует, а другой подавляет апоптоз) |
Дополнительные эффекторы апоптоза
Помимо каспаз существуют и другие эффекторы апоптоза. Например, флавопротеин AIF, высвобождающийся из межмембранного пространства митохондрий, действует по независимому от каспаз пути. Попадая в клеточное ядро, AIF вызывает конденсацию хроматина и активирует эндонуклеазы, которые участвуют в фрагментации ДНК. На основании экспериментальных данных установлено, что апоптоз, протекающий в присутствии AIF, не предотвращается ингибитором каспаз. В качестве эффекторов апоптоза также рассматриваются кальпаины — представители семейства цитозольных Ca-активируемых цистеиновых протеаз. Их роль в апоптозе пока слабо охарактеризована.
Деградационная фаза
Итогом программируемой клеточной гибели вне зависимости от изначального инициирующего воздействия является деградация клетки путём фрагментации на отдельные апоптотические тельца, ограниченные плазматической мембраной. Фрагменты погибшей клетки обычно очень быстро фагоцитируются макрофагами либо соседними клетками, минуя развитие воспалительной реакции.
Морфологические изменения
Условно деградацию погибающей клетки можно разделить на три последовательных фазы: высвобождения, блеббинга и конденсации. Деградация большинства клеток начинается с высвобождения прикреплений внеклеточного матрикса и реорганизации фокальной адгезии. Внутри погибающей клетки деполимеризуются микротрубочки цитоскелета. Внутриклеточные актиновые микрофиламенты реорганизуются в связанные с мембраной периферийные кольцевые пучки. В итоге клетка приобретает округлую форму. Следующая за высвобождением, стадия блеббинга, характеризуется сокращением периферийных актиновых колец. В результате сокращений клеточная мембрана образует вздутия, клетка как бы «кипит». Процесс блеббинга энергозависим и требует большого количества АТФ. Фаза блеббинга в нормальных условиях завершается примерно через час. В итоге клетка фрагментируется на маленькие апоптотические тела, либо целиком конденсируется, округляясь и уменьшаясь в размерах.
Биохимические изменения
На молекулярном уровне одним из последствий апоптоза является фрагментация ДНК с участием нуклеаз. Изначально образуются крупные фрагменты с 30 000—700 000 пар оснований, которые в дальнейшем расщепляются в межнуклеосомной области на отрезки по 180—190 пар оснований или кратные этим величинам. Фрагментация ДНК является характерным, но не обязательным признаком апоптоза, так как существуют наблюдения, в ходе которых процесс фрагментации ядра протекал без сопутствующей фрагментации ДНК.
Ещё одним существенным последствием апоптоза является экспрессия на внешней стороне плазматической мембраны специфических молекулярных маркеров, распознаваемых фагоцитирующими клетками: тромбоспондина; фосфатидилсерина и других фосфолипидов, содержащих фосфосерин.
Просмотров: 39583
|
|
